Биохимия клетки
Для успешной сдачи экзаменов важно не только знать теорию, но и уметь решать задания. Потренируйтесь в нашем банке заданий, чтобы закрепить материал для подготовки к ЕГЭ и ОГЭ.
В состав живых организмов входит более 70 химических элементов-биогенов. Их можно разделить на три группы:
Макроэлементы (почти 99,9 %):
- С, О, Н, N – органогены (98%), образуют основные классы органических соединений;
- S (Сера): входит в состав радикала некоторых аминокислот (метионин и цистеин);
- P (Фосфор): входит в состав зубов и костей, фосфолипидов мембраны, а также в состав ДНК, РНК и АТФ;
- Ca (Кальций): входит в состав зубов и костей, участвует в мышечном сокращении, является фактором свертывания крови, стимулирует работу сердца;
- Na, K (Натрий и Калий): обеспечивают проницаемость клеточных мембран для различных веществ (создают трансмембранный потенциал) и проведение нервного импульса;
- Mg (Магний): входит в состав хлорофилла, также может являться коферментом холоферментов;
- Cl (Хлор): входит в состав соляной кислоты, которая является компонентом желудочного сока, активизирует деятельность пищеварительных ферментов и обеззараживает пищу.
Микроэлементы (0,1 до 0,001%):
- Fe (Железо): ионы данного элемента входят в состав гемоглобина, миоглобина (кислород-связывающий белок скелетных и сердечной мышц), хрусталика и роговицы глаза, являются активаторами ферментов, участвуют в синтезе хлорофилла;
- I (Йод): входит в состав гормонов щитовидной железы;
- F (Фтор): входит в состав костей и эмали зубов. Микроэлементы (0,1 до 0,001%);
- Co (Кобальт): участвует в кроветворении;
- Cu (Медь): участвует в процессе фотосинтеза и в кроветворении;
- Zn (Цинк): входит в состав многих ферментов (кофермент) и в состав молекулы гормона поджелудочной железы - инсулина;
- Mo (Молибден): входит в состав многих ферментов, участвует в процессе фотосинтеза.
Ультрамикроэлементы (остаточные компоненты):
- Se (селен);
- Au (золото);
- Ag (серебро);
- Hg (ртуть).
Неорганические соединения
Минеральные вещества в клетках присутствуют в виде ионов и твёрдых нерастворимых солей. Нерастворимые соли представлены в основном фосфатами и карбонатами, входящими в состав костей, зубов, раковин и т. п. Растворимые ионы придают внутренней среде клетки определённую кислотно-щелочную реакцию, активизируют синтез ферментов, а также служат компонентами буферных систем – систем, которые избирательно связывают избыточные ионы Н+ и ОН- и позволяют поддерживать pH внутренней среды клетки на определённом уровне.
В клетке действуют три буферные системы: фосфатная (НРО /НРО ), карбонатная (НСО /НСО) и белковая.
Фосфатная буферная система поддерживает pH клетки в пределах 6,9—7,4. При избытке ионов водорода они связываются с первой частью системы: Н + НPO.
При избытке гидроксид-ионов вступает в действие второй компонент системы: OН + Н2PO4 = HPO4 + H2O.
Свойства воды
1) Полярность молекул – определяет её функции универсального растворителя гидрофильных соединений;
2) Когезия – сцепление молекул между собой и адгезия – сцепление с другими молекулами;
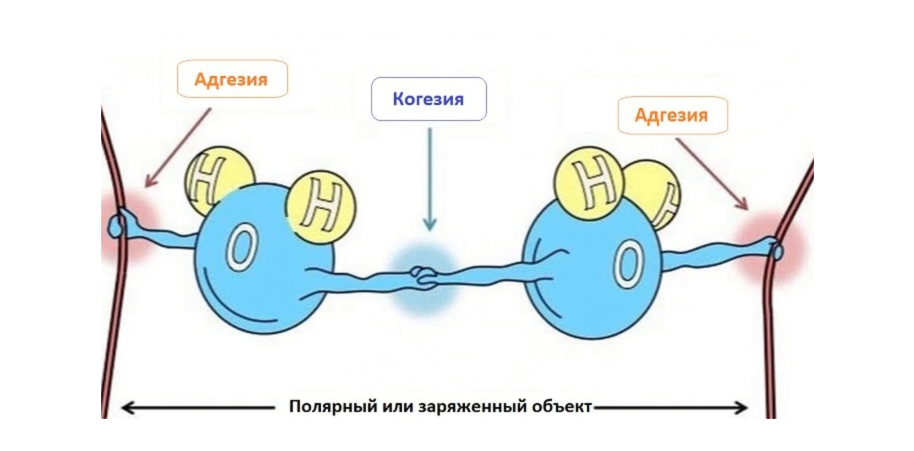
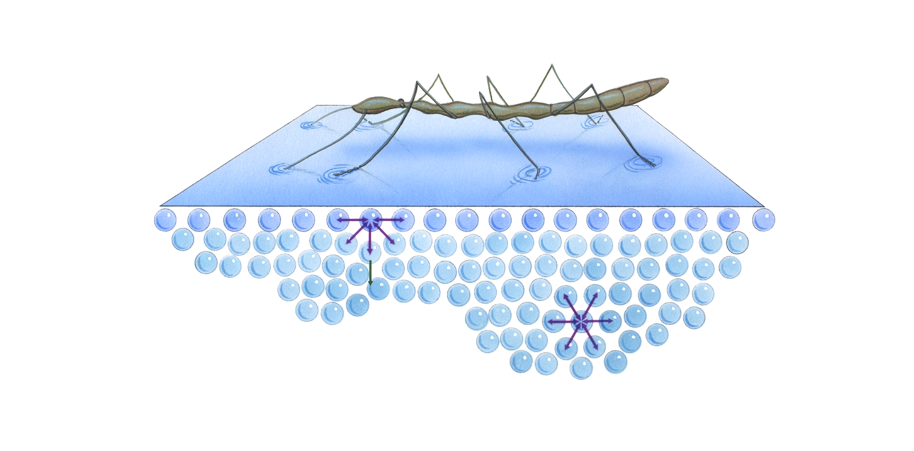
3) Высокое поверхностное натяжение воды и ее капиллярные свойства за счет ее полярности и водородных связей. Благодаря поверхностному натяжению на поверхности воды образуется «пленка», на которой могут обитать некоторые организмы (водомерка);
4) Аномально высокая удельная теплоемкость. Вода медленно нагревается и медленно остывает. Благодаря этому обеспечивается стабильность водной среды (поддержание постоянного температурного режима, отсутствие резких перепадов температур);
5) Высокая теплопроводность. Благодаря этому свойству тепло быстро и равномерно распределяется по всему объёму воды, находящейся в клетках, что препятствует их перегреванию в отдельных точках;
6) Расширение при замерзании. Когда вода замерзает, ее молекулы выстраиваются в кристаллическую решетку. Эта структура менее плотная, и т.к. между отдельными молекулами воды в этой структуре есть промежутки, общий объем увеличивается, и вода расширяется (занимает больший объем). 5 6 Именно поэтому, кристаллизуясь в замкнутых сосудах или живых клетках, вода может разорвать их стенки, разрушить клеточные органоиды;
7) Маленькие размеры. Несмотря на то, что молекулы воды полярны и нерастворимы в жирах они проникают в клетку через плазматическую мембрану путем простой диффузии за счет своих маленьких размеров;
8) Вязкость. Определяет свойства слизей, секретов, внутренней среды;
9) Прозрачность. Обеспечение фотосинтеза на большой глубине;
10) Несжимаемость. Поддержание формы тела многих организмов.
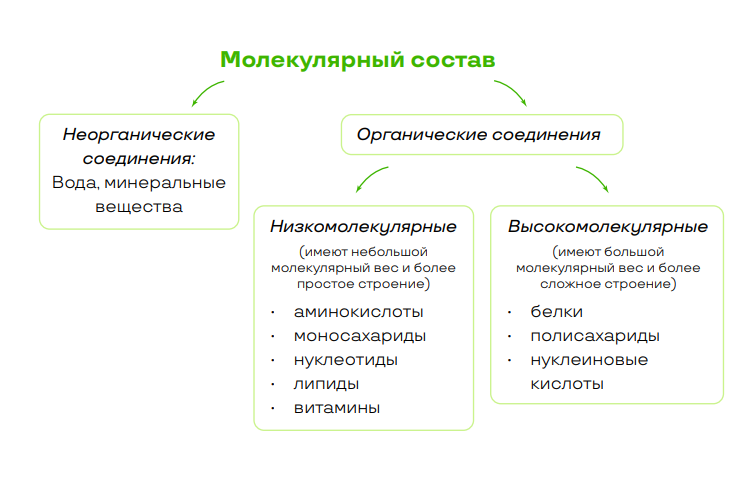
Органические соединения
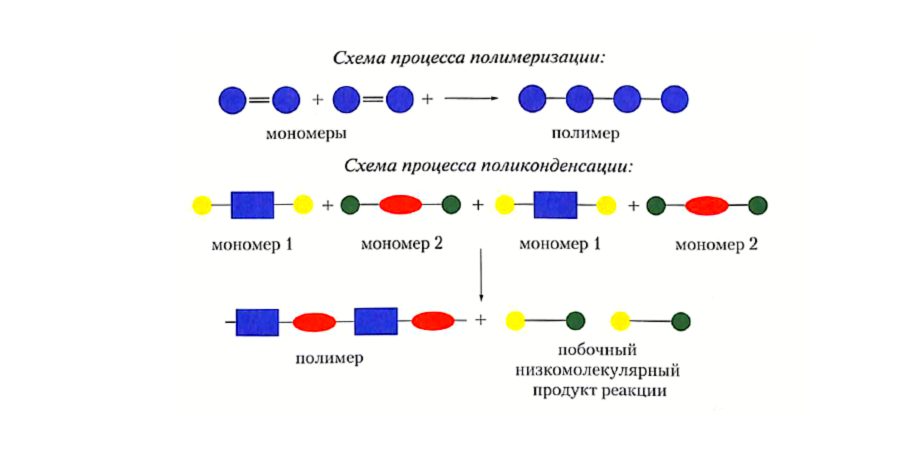
- Мономер - это низкомолекулярное органическое вещество, образующее полимер в реакции полимеризации;
- Полимер (биополимер) – высокомолекулярное органическое вещество, состоящее из множества повторяющихся звеньев (мономеров);
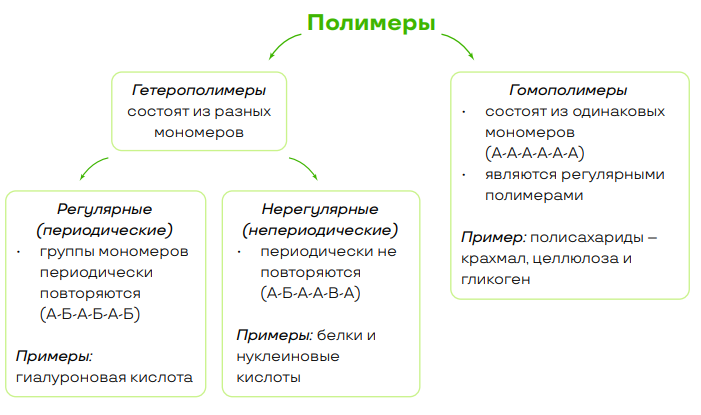

• непериодические полимеры с большой молекулярной массой, мономерами которых являются аминокислоты;
• занимают первое место по количеству и значению (у животных на них приходится около 50% сухой массы тела) • количество аминокислот в одной молекуле может колебаться:
- от 2 до 10 аминокислот – олигопептиды (дипептиды, трипептид, тетрапептид и тд);
- от 20 и более аминокислот – полипептид;
- полипептиды из более чем 50 аминокислот – белки* (например, белок инсулин содержит 51 аминокислоту).
• в состав могут входить небелковые компоненты, содержащие комплексы металлов и органических веществ.
Строение аминокислот
Все аминокислоты имеют общий план строения:
• Аминогруппа: одинакова во всех АК, обеспечивает их основные свойства;
• Карбоксильная группа: одинакова во всех АК, обеспечивает их кислотные свойства. Следовательно, аминокислоты – амфотерные соединения.
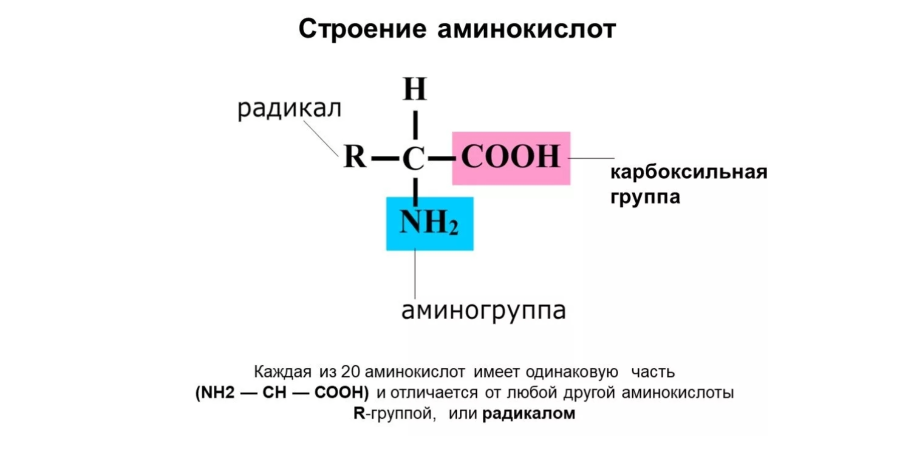
• Радикал: у каждой аминокислоты имеет свое строение и месторасположение. Свойства радикалов неодинаковы: одни из них гидрофильны, другие гидрофобны (неполярны), третьи характеризуются кислотными или основными свойствами. Именно свойства радикалов аминокислот и место их локализации в полипептидной цепи во многом определяют свойства всей белковой молекулы и её пространственную конфигурацию.
Радикалы 2 аминокислот – цистеин и метионин содержат в своем составе серу.

Аминокислоты способны связываться друг с другом с помощью пептидных связей.
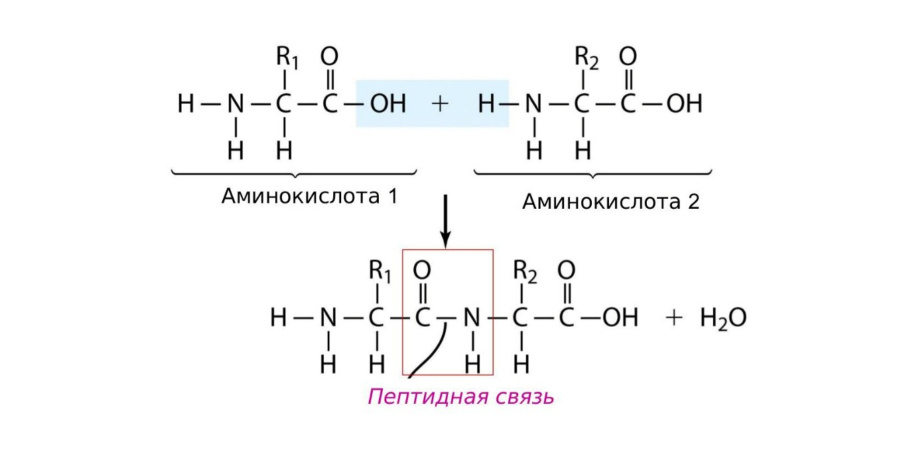
Пептидная (амидная) связь — прочная связь (вид ковалентной связи) между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты.
Структуры белка
1) Первичная структура:
• представляет из себя линейную последовательность аминокислот в полипептидной цепи (впервые была расшифрована у инсулина);
• типы связей – пептидные;
• именно первичная структура определяет свойства и функции белка.
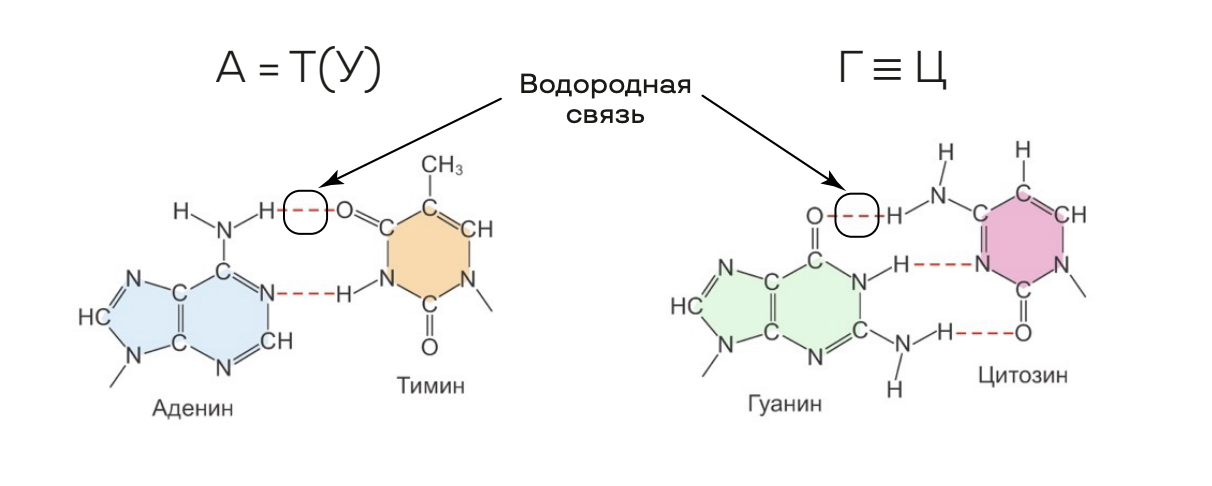
2) Вторичная структура — это определённая компоновка полипептидной цепи за счёт водородных связей, возникающих между СО– и NH–группами.
• существуют два типа вторичной структуры: альфа-спираль и бета-структура;
• типы связей: пептидные, водородные.
3) Третичная структура — это пространственная конфигурация белка в виде компактных глобул или фибрилл.
• начиная с третичной структуры белок начинает проявлять свои свойства и функции;
• выявлена с помощью рентгеноструктурного анализа;
• характерна для большинства белков;
• типы связей: пептидные, гидрофобные взаимодействия, дисульфидные мостики (S–S связь), ионные и водородные (последние 4 возникают между радикалами аминокислот).
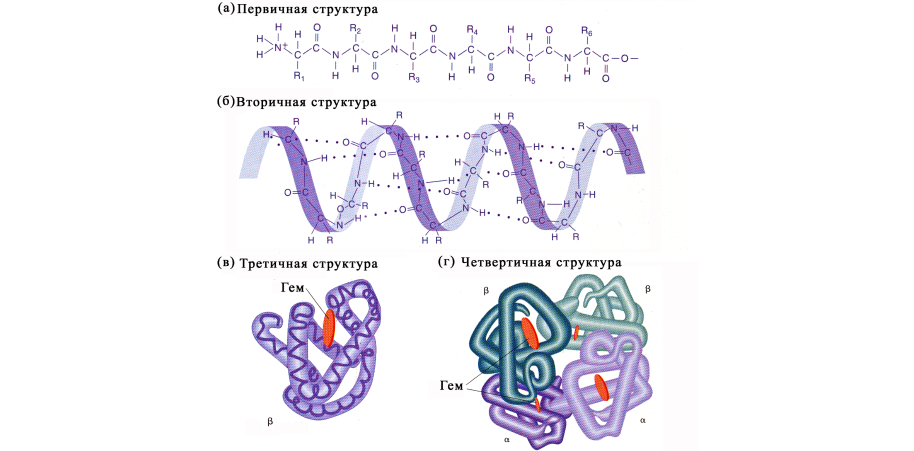
4) Четвертичная структура — комплекс из глобул и неорганических компонентов.
• типы связей: те же, что и в третичной структуре (основные – ионные).
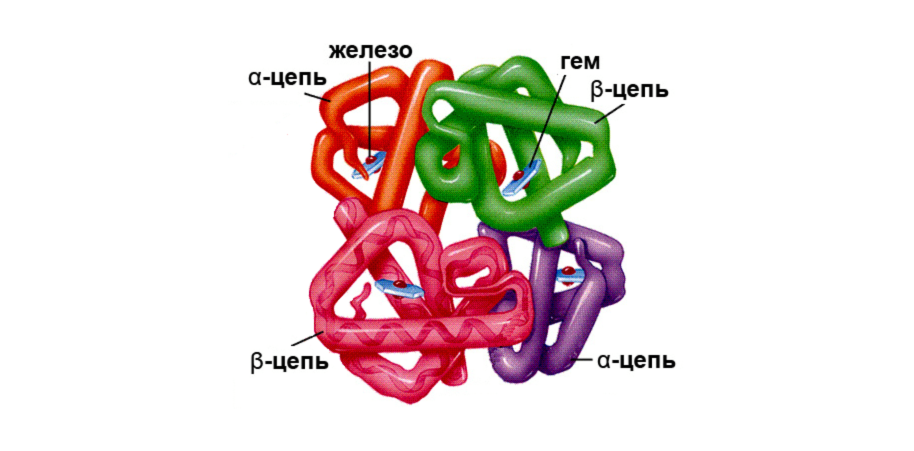
Классификация белков по строению
- Простые (протеины) - состоят только из полипептидных цепей:
- Примеры: альбумины, глобулины (антитела и фибриноген крови), основные белки-гистоны, фибриллярные белки (кератин, коллаген волос и сухожилий)4
- Сложные (протеиды) - имеют в составе небелковый компонент:
- Примеры: гликопротеиды, фосфопротеиды, липопротеиды и др.
Классификация белков по форме
- Глобулярные:
• имеют вид компактных телец (глобул);
• растворимы в воде;
• выполняют разнообразные функции (транспортные, регуляторные, каталитические и тд.);
Примеры: антитела, ферменты, миоглобин и т.д.
- Фибриллярные
• длинные тяжи (нити или волокна);
• нерастворимы в воде;
• обладают большой механической прочностью;
• выполняют структурную и сократительную функции.
Примеры: коллаген, кератин, эластин, актин и миозин, белки шелка и паутины (фиброин).

Денатурация
– изменение структуры и потеря белком его природных (нативных/исходных) свойств и структуры под воздействием некоторых факторов.

Денатурация бывает обратимой и необратимой:
Обратимая денатурация (ренатурация)
Денатурация обратима, если не нарушена первичная структура белка (то есть не разрушены пептидные связи). В таком случае возможна ренатурация – восстановление структуры и свойств белка при его возвращении в исходные физиологические условия.
Условия, при которых денатурация обратима: • незначительное повышение температуры (для большинства белков до 40 градусов С) • охлаждение • воздействие солей легких металлов (Na, K, Ca и тд).
Необратимая денатурация
Денатурация необратима, если нарушена первичная структура белка.
Условия, при которых денатурация необратима:
• сильное повышение температуры (для большинства белков выше 40-50 градусов С);
• воздействие концентрированных кислот и щелочей, а также солей тяжелых металлов (ртуть Hg, свинец Pb, мышьяк As, серебро Ag и тд.);
• радиоактивное, УФ излучение • воздействие органических растворителей, растворов ПАВ.
Функции белков
1) Ферментативная
Ферменты (энзимы) – биологические катализаторы, ускоряющие биохимические реакции и при этом не расходующиеся.
Зависимость скорости ферментативных реакций от различных факторов.
На скорость ферментативных реакций могут оказывать влияние многие различные факторы:
- зависимость от концентрации фермента: скорость реакции прямо пропорциональна концентрации фермента.
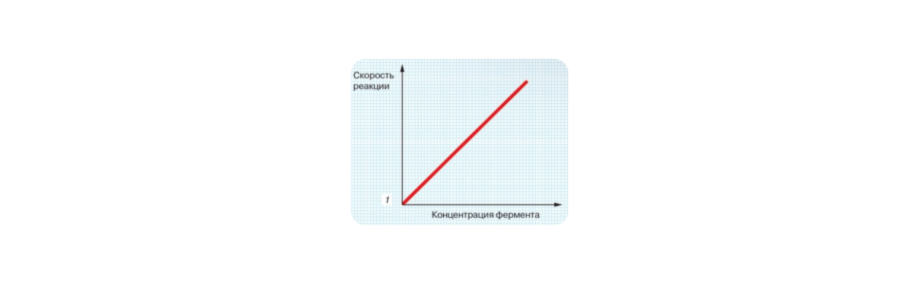
- зависимость от концентрации субстрата: при увеличении концентрации субстрата скорость сначала будет расти, а затем выходит на плато, так как все активные центры ферментов будут заняты. Это говорит о том, что число молекул фермента определяет, как быстро будет происходить химическая реакция.

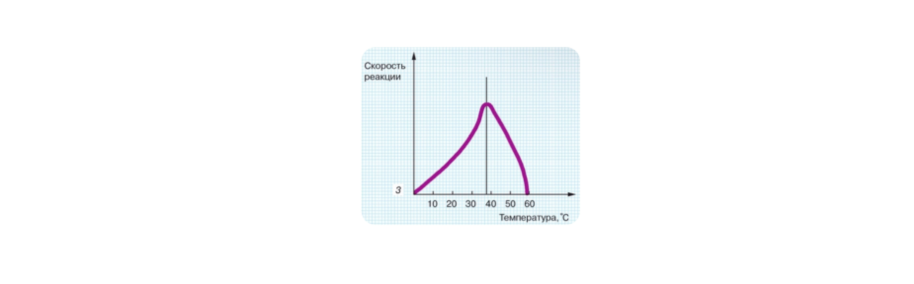
- зависимость от температуры: с повышением температуры скорость реакции возрастает, но после определенного значения (температурного оптимума*) скорость будет снижаться, так как фермент денатурирует, то есть сворачивается и полностью разрушается.
Температурный оптимум* – это значение температуры, при котором каталитическая активность ферментов достигается максимальной. Температурный оптимум для большинства ферментов млекопитающих составляет 37-39 С. У бактерий он может достигать намного больших значений.
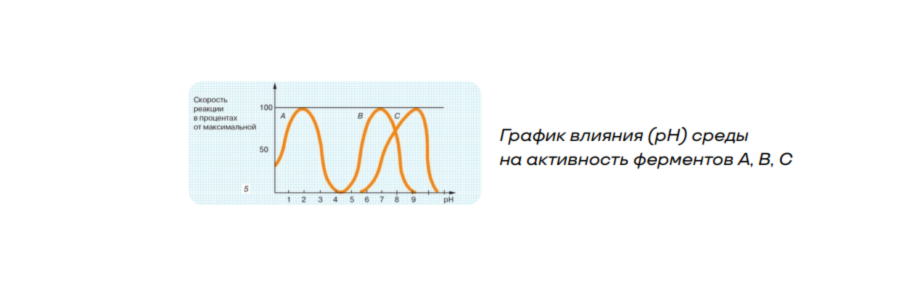
- зависимость от кислотности (pH) среды: на активность фермента и скорость реакции влияет pH среды. Ферменты активны при различной концентрации ионов Н+ и ОН- .
Большинство из них работают эффективно в узких пределах pH, чаще в нейтральной среде. Сдвиг концентрации ионов водорода может изменить электрический заряд белка-фермента, что приведёт к изменению конфигурации молекулы и падению активности. Некоторые ферменты работают в слабощелочной среде, например амилаза слюны. Фермент желудка пепсин наиболее активен в кислой среде.
Отличия и сходства ферментов от неорганических катализаторов



• органические соединения с общей формулой Cn(H2O)m;
• бывают простыми и сложными (полисахариды);
• мономером у полисахаридов преимущественно – глюкоза (в тестовой части могут написать, что углеводы имеют один тип мономеров – глюкозу);
• мономеры соединяются между собой с помощью гликозидной связи.
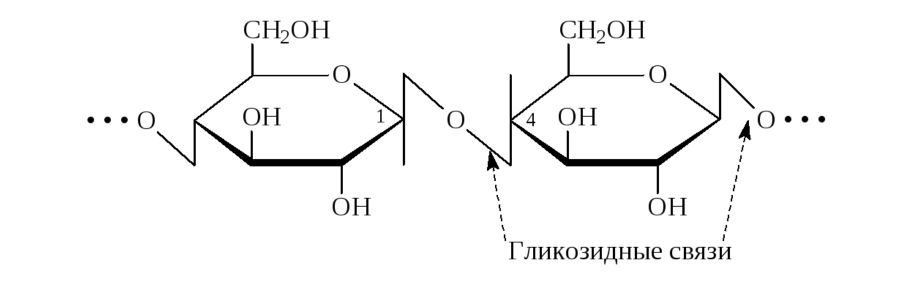
Моносахариды:
• НЕ подвергаются гидролизу;
• бесцветные кристаллические вещества, гидрофильные, сладкие на вкус.

Олигосахариды (дисахариды):
• гидролизуются;
• бесцветные кристаллические вещества, гидрофильные, сладкие на вкус;
• образованы двумя остатками простых сахаров:
Сахароза (свекловичный сахар) = глюкоза + фруктоза;
Лактоза (молочный сахар) = галактоза + глюкоза;
Мальтоза (солодовый сахар) = глюкоза + глюкоза.

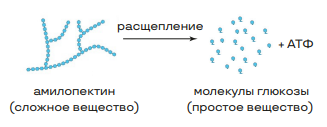
Полисахариды:
• гидролизуются;
• несладкие, нерастворимые в воде;
• высокомолекулярные вещества, периодические полимеры.

Крахмал имеет две структуры: амилозу с длинными не разветвленными цепями и амилопектин с разветвленными цепями. Полисахариды можно обнаружить с помощью качественных реакций: йод с крахмалом даёт синее окрашивание, а с гликогеном — красно-бурое.
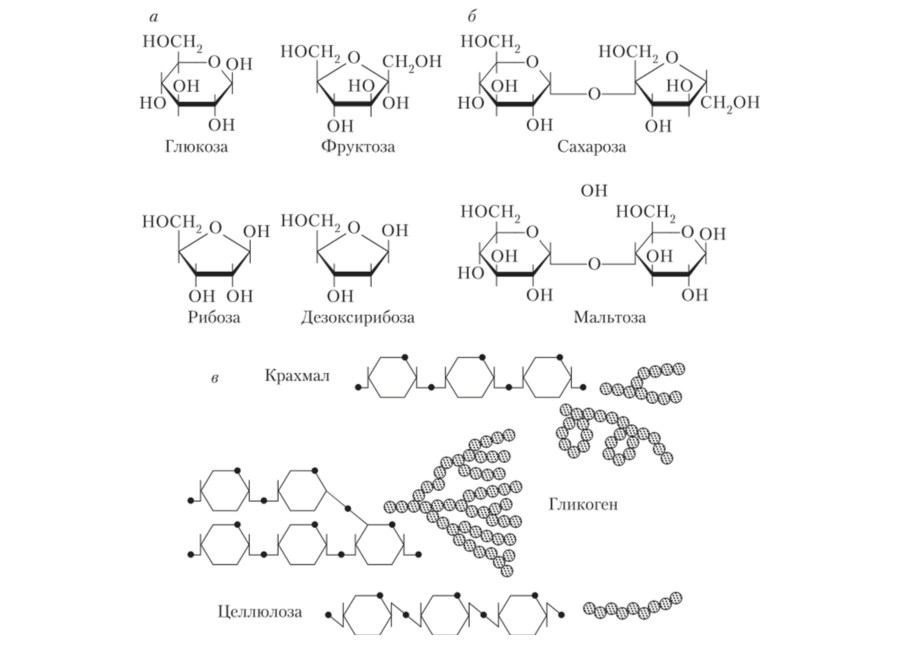
Функции углеводов
1) Энергетическая – углеводы являются основным источником энергии: при окислении 1 г углеводов образуется 17,6 кДж, что в 2 раза меньше, чем при окислении жиров, но углеводы значительно быстрее расщепляются и усваиваются организмом;
2) Запасающая – гликоген у животных и грибов, крахмал у растений;
3) Структурная (пластическая/строительная) – целлюлоза входит в состав клеточной стенки растений, хитин в состав клеточной стенки грибов (а также в состав экзоскелета членистоногих) и муреин в состав клеточной стенки бактерий;
4) Рецепторная (сигнальная) – олигосахаридные цепи вместе с липидами образуют гликолипиды, а вместе с протеинами – гликопротеины (гликопротеиды) на поверхности мембран животных клеток;
5) Защитная – углеводы входят в состав защитных слизей у животных и смолы у растений.
Также являются криопротекторами (антифризами) – защищают клетки от разрывов при низких температурных условиях.


НЕ ЯВЛЯЮТСЯ ПОЛИМЕРАМИ (следовательно, не имеют мономеров).
• неполярны, нерастворимы в воде, но растворимы в органических растворителях (бензол, ацетон, эфиры и тд).
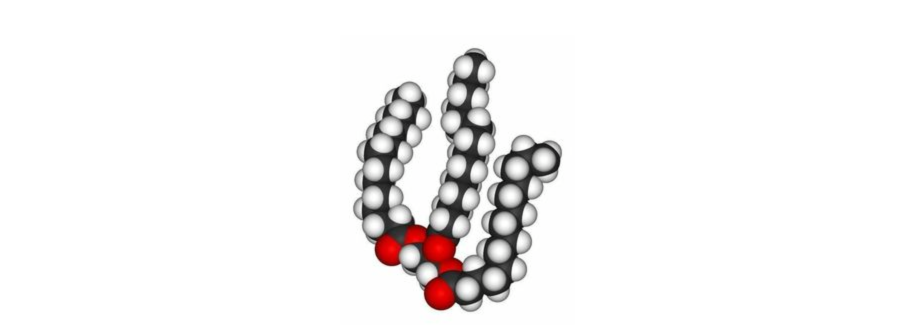
Триглицериды (жиры)
• самая распространенная группа липидов;
• состоят из гидрофильной головки (остатка глицерина) и трех гидрофобных хвостов (трех остатков высших жирных кислот).
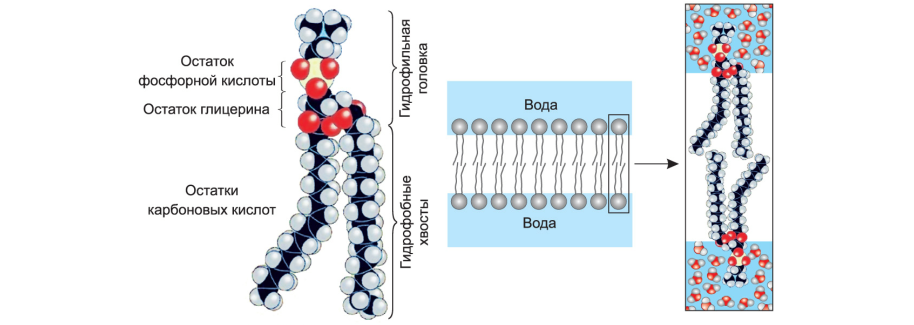
Фосфолипиды
• распространенная группа липидов;
• состоят из гидрофильной головки (остатка глицерина и остатка фосфорной кислоты) и двух гидрофобных хвостов (двух остатков высших жирных кислот);
• гидрофильные свойства выражены сильнее, чем у триглицеридов (так как один остаток ВЖК замещен на остаток фосфорной кислоты).
Воски и стероиды
Воски:
• пчелиный, растительный.
Стеролы (стерины) – представители стероидов:
• холестерин и его производные – гормоны стероидной природы.
Холестерин придает прочность мембранам животных клеток, регулирует их текучесть (при повышении температуры снижает текучесть мембраны, при понижении - повышает). Необходим для синтеза стероидных гормонов, желчных кислот и витамина D.
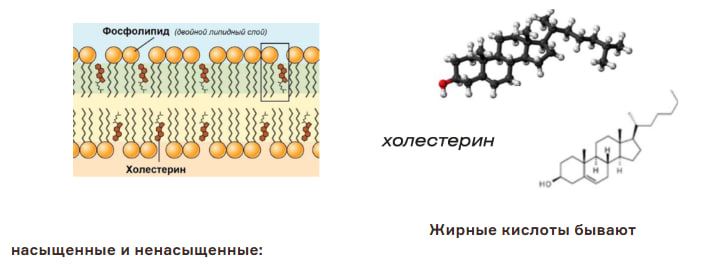
Насыщенные жирные кислоты:
• не имеют кратных связей;
• прямые молекулы;
• температура плавления выше, чем у ненасыщенных (при низких температурах - твердые);
• обычно входят в состав твердых животных жиров (исключение – рыбий жир).

Ненасыщенные жирные кислоты:
• имеют кратные связи;
• молекулы имеют изгибы в местах кратных связей;
• температура плавления ниже, чем у насыщенных (при низких температурах – жидкие);
• обычно входят в состав жидких растительных масел (исключение – пальмовое (кокосовое) масло, масло какао).

Функции липидов:
1) Энергетическая: липиды — самые энергоемкие вещества Высокая энергоёмкость веществ объясняется наличием большого числа восстановленных атомов, способных при окислении выделять энергию: Полное расщепление 1 г липида дает 38,9 кДж энергии;
2) Запасающая: живые организмы могут накапливать жировые капли в клетках;
3) Защитная: жировой слой обеспечивает амортизацию при падениях, восковой налёт на листьях растений предохраняет их от избыточного испарения, иссушения, воздействия низких температур и солнечных лучей. Триглицериды и воски образуют водоотталкивающую плёнку на коже, перьях, шерсти животных;
4) Терморегуляционная: липиды обеспечивают сохранение тепла (теплоизоляцию);
5) Источник метаболической (эндогенной) воды: окисление 1 г липидов дает 1,1 г воды (пример – верблюжьи горбы);
6) Структурная (строительная): липиды (преимущественно фосфолипиды) составляют основу биологических мембран;
7) Рецепторная (сигнальная): входят в состав рецепторов – гликолипидов мембран животных клеток;
8) Регуляторная: некоторые гормоны имеют липидную природу: например, минералкортикоиды (альдостерон), глюкокортикоиды (кортизон, кортизол, кортикостерон) и половые гормоны (андрогены (тестостерон), эстрогены (эстрадиол) и прогестероны).
Чтобы уверенно применять знания о биохимии клетки на ЕГЭ, решайте задания на эту тему в банке заданий для ЕГЭ.
Популярные статьи
Дата публикации: 09.10.2025 20:26
Поделиться